明日叶查耳酮对Ⅱ型糖尿病大鼠脂代谢的影响
摘 要
目的:
研究明日叶查耳酮和游泳运动对Ⅱ型糖尿病大鼠脂代谢的影响。
*AD:关于明日叶,免费咨询更多,添加微信:156440577
方法:
注射链脲佐菌素诱导成年雄性Sprague-Dawley(SD)大鼠糖尿病模型,观察补充明日叶查耳酮、游泳运动、游泳运动结合补充明日叶查耳酮,以及阳性药物二甲双胍对糖尿病大鼠血清甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、低密度脂蛋白(low density lipoprotein,LDL)、高密度脂蛋白(high density lipoprotein,HDL)、游离脂肪酸(free fatty acid,FFA)水平的影响,以及对肝脏内脂素(visfatin)mRNA、甘油-3-磷酸酰基转移酶-1(glycerol-3-phosphate acyltransferase-1,GPAT-1)mRNA、肉碱棕榈酰转移酶-1(carnitine palmitoyl transferase-1,CPT-1)mRNA相对表达量的影响。
结果:
与糖尿病组比较,各干预组大鼠的TG 、TC、LDL、FFA水平显著下降,HDL水平显著升高;各干预组大鼠肝脏visfatin mRNA、GPAT-1 mRNA相对表达量显著下降;肝脏CPT-1 mRNA相对表达量则均显著升高。
结论:
明日叶查耳酮有很好的改善糖尿病大鼠脂代谢的能力,并且与游泳运动产生协同效果。
关键词:明日叶查耳酮;运动;糖尿病;脂代谢
*AD:免费领取明日叶30粒、茶包体验装,添加微信:156440577
Ⅱ型糖尿病(type Ⅱ diabetes mellitus,T2DM)是以高血糖和胰岛素抵抗(insulin resistance,IR)为主要特征的代谢性疾病[1]。而饮食的高糖高脂、日常运动过少等因素都是糖尿病形成的主要原因。传统的西药治疗常常使患者的用药量随着用药时间的延长而逐渐增加,投入的药物种类也常由单一逐渐变为联合,而药量增加与同时服用多种降糖药都不可避免地导致了对肝脏和肾脏的毒副作用,又会使患者对药物产生依赖作用[2]。随着病情的发展,许多病人又不断出现多种并发症。这些问题出现的原因在于糖尿病导致的体质变化未得到改善,提供了并发症的生理基础,这些发生于全身的病变正是西药治疗的薄弱环节[3]。
当今,运动和饮食调节对糖尿病的治疗作用越来越受到人们的重视。运动可以促进体内糖脂代谢,从而加速葡萄糖分解。天然保健食品往往含有多种有益健康的成分,大多为药食兼用的动、植物性食品,对人体的毒副作用小,也不会产生耐药性,药性温和,并可以通过对机体的全方位调理达到滋阴清热、补肾健脾、益气养阴、活血化瘀的目的,降低血糖水平,改善糖尿病症状,延长糖尿病人寿命。鉴于饮食和运动调节对糖尿病预防的重要意义,本研究探讨补充明日叶查耳酮和游泳运动对改善T2DM大鼠肝脏脂代谢的可能影响。
1 材料与方法
1.1 动物、材料与试剂
8 周龄雄性Sprague-Dawley(SD)大鼠,体质量(180.0±18.8) g,购自北京维通利华实验动物技术有限公司。明日叶查耳酮、链脲佐菌素(streptozocin,STZ)美国Sigma公司。盐酸二甲双胍缓释片哈尔滨同一堂药业公司;血清甘油三酯(triglyceride,TG)测定试剂盒、总胆固醇(total cholesterol,TC)测定试剂盒、高密度脂蛋白(high density lipoprptein,HDL)测定试剂盒、低密度脂蛋白(low density lipoprotein,LDL)测定试剂盒、游离脂肪酸(free fatty acid,FFA)测定试剂盒南京建成生物工程研究所;RNAstore样品保存液、血清内脂素(visfatin)检测试剂盒、实时荧光定量聚合酶链式反应(polymerase chain reaction,PCR)试剂盒SYBRFAST qPCR Kit 天根生化科技(北京)有限公司;Trizol试剂、逆转录试剂盒PrirneScriptⅡ 1st Strand cDNASynthesis Kit 宝生物工程(大连)有限公司。
1.2 仪器与设备
S22PC分光光度计、DYY-Ⅲ31A/31B型电泳槽北京六一仪器厂;ABI 2720 PCR仪美国AppliedBiosystems PE公司;DNA Engine PCR仪、Quantityone凝胶分析软件美国Bio-Rad公司;VILBER LOURMAT荧光-化学发光成像系统法国Vilber公司。
*AD:选购明日叶种子、种苗等,基地直发,添加微信:156440577
1.3 方法
1.3.1 T2DM大鼠模型制备、分组及运动训练方案将65 只雄性SD大鼠普通饲料喂养1 周后,随机分为正常对照组(NC组,8 只)和造模组(57 只)。正常对照组继续以普通饲料喂养,造模组以高糖高脂饲料喂养,高糖高脂饲料包括(以下均为质量分数)20%蔗糖、10%猪油、5%蛋黄粉、0.2%胆酸钠、64.8%基础饲料。给予造模组大鼠高糖高脂饲料5 周后,按照35 mg/kg(以体质量计,下同)腹腔注射STZ,并继续维持高糖高脂饮食。正常对照组大鼠注射同等剂量的柠檬酸钠缓冲液。注射3、7 d后,从各组大鼠尾静脉取血测定随机血糖浓度,血糖浓度均大于16.7 mmol/L为造模成功大鼠。本实验中,造模成功率为89.1%。选取造模成功的S D 大鼠4 0 只, 随机分为5 组: 糖尿病组(DM组) 、二甲双胍组( S 组,5 0 m g / ( k g • d ) ) 、明日叶查耳酮组(CA组,20 mg/( k g • d ) ) 、运动组(CE组) 、明日叶查耳酮+ 运动组(CACE组, 2 0 m g / ( k g • d ) ) ,每组8 只,正常对照组大鼠灌胃等剂量的无菌水。各组灌胃给药均于每天下午17:00左右进行,之后以普通饲料继续喂养各组大鼠8 周并进行运动训练。运动训练采取8 周不负重的游泳训练。先进行为期1 周的适应性训练(10 min/d),之后进行正式训练,训练时间为:第1周15 min/d、第2周30 min/d、第3~8周45 min/d,每周训练6 d。游泳训练在白色大水桶中完成,每桶4 只大鼠,水深60 cm,水温(32±2) ℃,
每次游泳结束立即用干毛巾将大鼠体表水分轻柔挤压吸干。
1.3.2 样品制备
运动训练8 周后,各组大鼠眼球取血,分离得血清备用。取血后脱颈处死大鼠,迅速取肝脏用锡纸包裹投入液氮冷冻,之后保存于-80 ℃冰箱备用。
1.3.3 指标测定
大鼠血清TG、TC、HDL、LDL、FFA含量均采用试剂盒测定,具体操作步骤按照说明书方法进行。肝脏组织visfatin mRNA、甘油-3-磷酸酰基转移酶-1(glycerol-3-phosphate acyltransferase-1,GPAT-1)mRNA及肉碱棕榈酰转移酶-1(carnitine palmitoyltransferase-1,CPT-1)mRNA相对含量的测定:Trizol法提取肝脏细胞总RNA,琼脂糖凝胶电泳检测总RNA浓度,再根据逆转录试剂盒说明书方法操作获取cDNA,然后进行实时荧光定量PCR扩增。将β-actin作为内参基因,visfatin作为目的基因。对GPAT-1 mRNA及CPT-1mRNA的定量检测中,以18S rRNA作为内参基因。参考文献[4-6],用Primer5软件设计引物,进行实时荧光定量PCR。visfatin mRNA相对含量的定量PCR反应体系(10 μL):2×SYBR Green Master Mix 1.5 μL、1 μmol/L正向引物0.2 μL、1 μmol/L反向引物0.2 μL、10 ng/μL cDNA模板1 μL,ddH2O 7.1 μL。PCR扩增程序:94 ℃变性3 min;95 ℃变性30 s,60 ℃复性20 s,72 ℃延伸30 s,40 个循环;72 ℃延伸8 min。GPAT-1 mRNA及CPT-1 mRNA相对含量的定量PCR反应体系(10 μL):2×SYBR Green MasterMix 1.5 μL、1 μmol/L正向引物0.25 μL、1 μmol/L反向引物0.25 μL、10 ng/μL cDNA模板1.25 μL、ddH2O 6.25 μL。PCR扩增程序:94 ℃变性4 min;95 ℃变性30 s,62 ℃复性30 s,72 ℃延伸30 s,40 个循环;72 ℃延伸10 min。
1.4 数据分析
采用SPSS 13.0软件,组间差异比较采用独立样本t检验。P<0.05表示差异有统计学意义。
2 结果与分析
2.1 大鼠脂代谢相关血液指标的变化
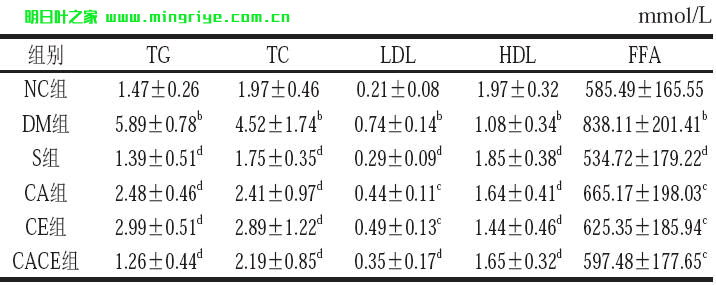
表 1 大鼠脂代谢相关血液指标含量
注:b. 与NC 组比较,差异极显著(P < 0.01);c. 与DM 组比较,差异显著(P < 0.05);d. 与DM 组比较,差异极显著(P < 0.01)。
由表1可知,与NC组比较,DM组大鼠血清TG、TC、LDL、FFA含量均极显著升高(P<0.01),HDL含量极显著降低(P<0.01)。实验8 周后,与DM组比较,S组大鼠血清TG、TC、LDL、FFA含量均极显著下降(P<0.01),HDL含量极显著升高(P<0.01);CA组大鼠血清TG、TC含量极显著下降(P<0.01),LDL、FFA含量显著下降(P<0.05),HDL含量极显著升高(P<0.01);CE组大鼠血清TG、TC含量均极显著下降(P<0.01),LDL、FFA含量显著下降(P<0.05),HDL含量极显著升高(P<0.01);CACE组大鼠血清TG、TC、LDL含量均极显著下降(P<0.01),FFA含量显著下降(P<0.05),HDL含量极显著升高(P<0.01)。
2.2 大鼠肝脏visfatin mRNA相对表达量
由图1可知,与NC组相比,DM组大鼠肝脏visfatinmRNA相对表达量极显著升高(P<0.01);与DM组相比,S组、CACE组大鼠肝脏visfatin mRNA相对表达量均极显著下降(P<0.01),CA组及CE组显著下降(P<0.05)。
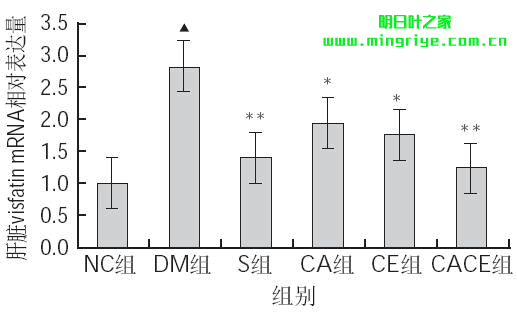
图 1 各组大鼠肝脏visfatin mRNA相对表达量
▲.与NC组比较,差异极显著(P<0.01);*. 与DM组比较,差异显著(P<0.05);**. 与DM组比较,差异极显著(P<0.01)。下同。
2.3 大鼠肝脏GPAT-1 mRNA相对表达量
由图2可知,与NC组相比,DM组大鼠肝脏GPAT-1mRNA相对表达量极显著升高(P<0.01);与DM组相比,S组大鼠肝脏GPAT-1 mRNA相对表达量极显著降低(P<0.01),而CA组、CE组及CACE组均显著降低(P<0.05)。
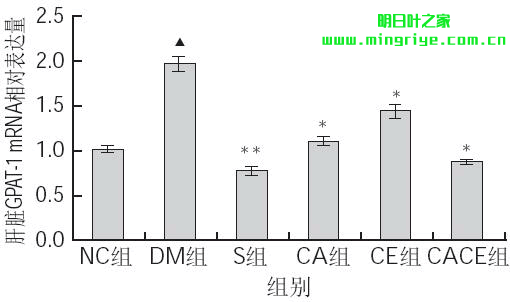
图 2 各组大鼠肝脏GPAT-1 mRNA相对表达量
2.4 大鼠肝脏CPT-1 mRNA相对表达量
由图3可知,与NC组相比,DM组大鼠肝脏CPT-1mRNA相对表达量极显著降低(P<0.01);与DM组相比,S组、CA组、CE组及CACE组大鼠肝脏CPT-1 mRNA相对表达量均极显著升高(P<0.01)。
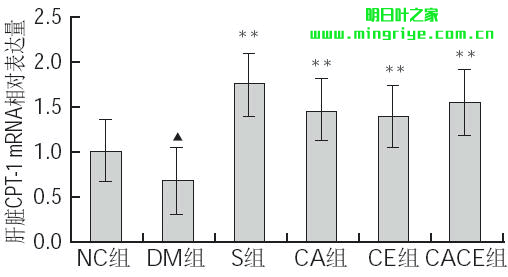
图 3 各组大鼠肝脏CPT-1 mRNA相对表达量
3 讨论与结论
明日叶是伞形科多年生草本植物,具有多种功效,如增强人体免疫力、抗氧化、抗衰老、抗肿瘤、抗菌消炎、降低血糖和血脂水平等[7],其中降糖作用尤为显著。明日叶中主要活性成分为查耳酮。
查耳酮类化合物属于黄酮类物质,是一种植物色素,含有1,3-二苯基丙烯酮结构。查耳酮类化合物具有多种生物学活性,如降血糖、降血脂、抗氧化等。目前,有很多关于明日叶查耳酮对糖尿病防治作用的研究,认为查耳酮有很强的胰岛素样活性,能够增强胰岛素功能、降低血糖浓度[8]。
糖尿病患者一般都存在血脂异常的状况,甚至发生脂肪肝病变。这与糖尿病患者在糖代谢异常的同时一般都伴随脂代谢异常相关[9]。血脂代谢异常是糖尿病及其并发症的主要危险因素。糖尿病的脂代谢异常典型表现为FFA、TG、TC、LDL水平升高,HDL水平降低。研究表明,脂代谢紊乱特别是TG和FFA水平增高是糖尿病的诱发因素[10]。糖尿病的早期症状之一常表现为TG水平升高[11]。FFA主要为皮下和内脏脂肪脂解产生,分解产生的FFA在肝脏中作为底物合成TG。长期的高水平FFA易发生再脂化,并异位沉积于非脂肪器官,使周围组织对胰岛素敏感性降低,最终使胰岛素分泌发生障碍[12]。因此,加速脂类分解,改善脂代谢状况,既可以提高葡萄糖的利用率,又可以减少糖异生,从而降低血糖浓度,达到预防和治疗糖尿病的目的。
运动对血脂代谢的改善作用已经得到了证实。尤其是中等强度的有氧运动,可以通过改善机体氧化应激来增加抗氧化酶的活力,从而增强机体抗氧化能力[13]。本实验中,运动组大鼠血清TG、TC、LDL、FFA水平都明显降低,而HDL水平明显升高。本实验结果也进一步证实了前人的研究,并且实验结果显示明日叶查耳酮对糖尿病大鼠血清的脂代谢相关指标也有显著改善作用。本研究结果表明,运动与明日叶查耳酮表现出协同效应,两者配合可能对血脂指标的改善作用更强。
Visfatin是Fukuhara等[14]在2005年发现的一种内脏脂肪细胞因子,在脂肪细胞分化和葡萄糖代谢中有特殊的重要作用。它具有类似胰岛素样的降血糖作用,并能促进前内脏脂肪细胞分化,促进内脏脂肪合成和聚集,可能参与肥胖等疾病的发生发展,是糖脂代谢重要影响因子[15-18]。本实验中,糖尿病组大鼠肝脏visfatin mRNA水平比正常对照组极显著升高,可能是因为糖尿病大鼠糖代谢异常,血糖水平的升高使机体产生相应的代偿反应,各组织分泌更多visfatin,模拟胰岛素降糖作用,以补充胰岛素的相对不足,使作为调控机体糖代谢器官的肝脏中visfatin维持在较高水平。而各干预组与糖尿病组相比,肝脏visfatin mRNA水平都明显下降,可能是各干预组都不同程度地降低了糖代谢异常的情况而使肝脏visfatin分泌减少,而且明日叶查耳酮与运动的共同作用要优于二者单独使用的效果。
GPAT-1、CPT-1是脂肪酸β-氧化的关键酶[5,19]。GPAT-1可以将脂肪酸酯化为TG储存起来[20]。CPT-1是脂肪酸氧化过程中的一种限速酶,催化脂肪酸转运至线粒体基质进行β-氧化[21-22]。它位于线粒体外膜,通过过氧化物酶体增殖物激活受体、丙二酰辅酶A进行磷酸化、脱磷酸化依赖的细胞骨架成分在转录水平、翻译及翻译后水平接受调节,在能量代谢中起关键作用[23-24]。本研究中,糖尿病组大鼠肝脏的GPAT-1 mRNA水平比正常对照组极显著升高,与血清TG水平的变化趋势一致,说明糖尿病组大鼠脂肪酸酯化加强,致使转化的TG含量增加。而明日叶查耳酮组大鼠肝脏的GPAT-1 mRNA水平比糖尿病组显著降低,CPT-1 mRNA水平比糖尿病组显著升高,表明明日叶查耳酮可能通过降低GPAT-1水平来减少TG的形成,同时提高GPAT-1水平而促进脂肪酸β-氧化,降低TG水平。本研究结果表明,明日叶查耳酮与运动对改善糖尿病大鼠脂代谢具有协同作用。
明日叶查耳酮能够促进大鼠体内脂肪酸β-氧化,降低脂肪酸的酯化水平,加速脂类分解,改善脂代谢。虽然其作用弱于二甲双胍,但是明日叶查耳酮可与运动产生整体的协同效果。
参考文献:
[1] 龚志刚, 朱笃, 张月华. 葛根素干预对糖尿病运动大鼠血清抗氧化能力的影响[J]. 食品科学, 2008, 29(9): 567-572.
[2] ACCILI D. 专家专题报告4: 2型糖尿病的新生物学进展[J]. 中华内分泌代谢杂志, 2014, 30(3): 269.
[3] 王昌儒. 温肾健脾化痰法对代谢综合征大鼠的作用机制研究[D]. 武汉: 湖北中医药大学, 2014: 12-14.
[4] 付鹏宇, 龚丽景, 赵林青, 等. 有氧运动和饮食干预对肥胖小鼠Visfatin水平的影响及其与氧化应激的关系[J]. 中国运动医学杂志,2014, 33(1): 52-58.
[5] EJAZ A, WU D, KWAN P, et al. Curcumin inhibits adipogenesis in3T3-L1 adipocytes and angiogenesis and obesity in C57/BL mice[J].The Journal of Nutrition, 2009, 139(5): 919-925.
[6] GAO Ye, ZHOU Yi, XU Aimin, et al. Effects of an AMP-activatedprotein kinase inhibitor, compound C, on adipogenic differentiation of3T3-L1 cells[J]. Biological & Pharmaceutical Bulletin, 2008, 31(9):1716-1722.
[7] 赵阳. 明日叶查尔酮对2型糖尿病大鼠葡萄糖转运体表达的影响[D].青岛: 青岛大学, 2013: 35-36.
[8] AUGUSTIN R. The protein family of glucose transport facilitators:it’s not only about glucose after all[J]. IUBMB Life, 2010, 62(5):
315-333.
[9] 王庆平, 曹卿, 钟进义, 等. 明日叶查尔酮对2型糖尿病大鼠胰岛素受体表达的影响[J]. 中国食物与营养, 2013, 19(1): 69-72.
[10] EL-ABHAR H S, SCHAALAN M F. Topiramate-induced modulationof hepatic molecular mechanisms: an aspect for its anti-insulin
resistant effect[J]. PLoS ONE, 2012, 7(5): e37757. doi: 10.1371/journal.pone.0037757.
[11] DOWMAN J K, TOMLINSON J W, NEWSOME P N. Pathogenesisof non-alcoholic fatty liver disease[J]. QJM, 2010, 103(2): 71-83.
[12] GARY W. Poss ible effects of dietary polyphenols onsugarabsorption and digestion[J]. Molecular Nutrition & Food
Research, 2013, 57: 48-57.
[13] 张裕中, 王银晖, 陈晓光, 等. 游泳运动和白藜芦醇对Ⅱ型糖尿病大鼠肝糖原及肝脏GLUT2的影响[J]. 中国运动医学杂志, 2014, 33(2):135-141.
[14] FUKUHARA A, MATSUDA M, NISHIZAWA M, et al. Visfatin: aprotein secreted by visceral fat that mimics the effects of insulin[J].Science, 2005, 307: 426-430.
[15] 陈宝. 有氧运动联合膳食控制对2型糖尿病大鼠血清Visfatin水平的影响及相关因素的研究[D]. 扬州: 扬州大学, 2009: 44-45.
[16] KIM S, KANG S, MOON N R, et al. Central visfatin potentiatesglucose-stimulated insulin secretion and β-cell mass withoutincreasing serum visfatin levels in diabetic rats[J]. Cytokine, 2014,65(2): 159-166.
[17] de LUIS D A, SAGRADO M G, CONDE R, et al. Relation of visfatinto cardiovascular risk factors and adipocytokines in patients withimpaired fasting glucose[J]. Nutrition, 2013, 29(11/12): 1300-1303.
[18] 李婧波, 李艳波. Visfatin与自身免疫性甲状腺疾病关系的研究[J].标记免疫分析与临床, 2010, 17(6): 355-358.
[19] LI Tuoping, LI Suhong, DONG Yinping, et al. Antioxidant activityof penta-oligogalacturonide, isolated from haw pectin, suppresses
triglyceride synthesis in mice fed with a high-fat diet[J]. FoodChemistry, 2014, 145(15): 335-341.
[20] PETRESCU A D, MCINTOSH A L, STOREY S M, et al. Highglucose potentiates L-FABP mediated fibrate induction of PPARα
in mouse hepatocytes[J]. Biochimica et Biophysica Acta (BBA)-Molecular and Cell Biology of Lipids, 2013, 1831(8): 1412-1425.
[21] YASUDA Y, HASHIMOTO R, OHI K, et al. A functionalpolymorphism of the GTP cyclohydrolase 1 gene predicts attentionperformance[J]. Neuroscience Letters, 2014, 566(30): 46-49.
[22] ZHANG Tianshun, SAWADA K, YAMAMOTO N, et al.4-Hydroxyderricin and xanthoangelol from ashitaba (Angelica keiskei)suppress differentiation of preadiopocytes to adipocytes via AMPKand MAPK pathways[J]. Molecular Nutrition & Food Research, 2013,57(10): 1729-1740.
[23] NEGI L M, JAGGI M, TALEGAONKAR S. Development ofprotocol for screening the formulation components and the assessment
of common quality problems of nano-structured lipid carriers[J].International Journal of Pharmaceutics, 2014, 64(1/2): 403-410.
[24] HSU W H, CHEN T H, LEE B H, et al. Monascin and ankaflavin actas natural AMPK activators with PPARα agonist activity to downregulatenonalcoholic steatohepatitis in high-fat diet-fed C57BL/6mice[J]. Food Chemical Toxicology, 2014, 64: 94-103.
*AD:购买明日叶茶、明日叶粉,十年品牌,品质护航,添加微信:156440577








